CORROSIE VAN STAAL
Staal is een actief metaal dat zichzelf daarom niet kan passiveren in tegenstelling tot metalen zoals aluminium, chroom, titaan en nikkel. Laatstgenoemde metalen hebben namelijk een oxidehuid die perfect past op het moedermateriaal waardoor het metaal zichzelf a.h.w. inpakt. Dat is bij staal niet het geval want de oxidehuid heeft meer volume nodig waardoor het zichzelf kapot drukt.
Zo kan water binnendringen om een nieuwe laag aan te tasten. Het gevolg is dat staal in een waterige oplossing gaat corroderen dat ook wel roesten wordt genoemd. Op de onderstaande afbeelding stelt de dikke grijze lijn de oxidehuid voor en zodra deze niet meer afsluit dan kruipt vocht naar binnen om de corrosie voort te zetten. De rode lijn stelt de nieuwe laag voor die door het inkruipende water aangetast wordt. Dit fenomeen is dus het geval bij ijzer en staal dat uiteindelijk dan ook door zal roesten.
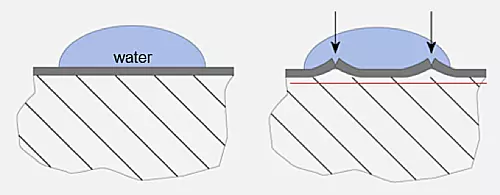
Het corrosiemechanisme
Corrosie vindt plaats op grond van twee reacties, namelijk de anodische en de kathodische reactie. Stopt een van de twee dan stopt de andere ook.
- De anodische reactie is de oxidatie van metaalatomen tot metaalionen die daarbij in oplossing gaan waardoor er elektronen worden geproduceerd die in het metaal achterblijven; een goed voorbeeld hiervan is Fe → Fe2+ + 2e-.
- De kathodische reactie is de reductie van een component uit het milieu waarbij elektronen aan het metaal worden onttrokken aan het metaaloppervlak, bijvoorbeeld volgens de formule 2H+ +2e- → H2↑
De reden dat staal gaat roesten, komt dat de anodische en de kathodische reacties beiden continue en met een bepaalde snelheid verlopen. Hiervoor moeten anode en kathode aan elkaar zijn verbonden, zodat er een elektronenstroom kan lopen met een voldoende stroomdichtheid van de anode naar de kathode. Als geleider is een elektrolyt nodig en dat kan water of condens zijn. Ook in die gevallen waarin het metaal schijnbaar niet nat is, kan er zich op het metaaloppervlak een uiterst dunne waterfilm bevinden. Door opgeloste bestanddelen is dit water elektrisch geleidend en kan er ook corrosie ontstaan.
De edelheidreeks
Als staal in een geleidende vloeistof wordt geplaatst en er wordt een elektrische verbinding tussen het staal en een waterstofelektrode aangebracht, dan zal er een elektrische stroom gaan lopen. Deze spanning is te meten met een voltmeter. De waarde die dan afgelezen wordt, is de elektrische potentiaal in edelheidreeks. Deze is voor staal (Fe) -0,44 Volt. In onderstaande afbeelding zijn deze potentialen van verschillende metalen te zien. Alles wat zich links van de ‘waterstoflijn’ (H) bevindt zijn actieve metalen en rechts zijn de passieve c.q. edele metalen weergegeven. Dankzij voldoende chroom wordt het staal een passief metaal maar dat geldt alleen voor de oxidehuid. Dit is te zien bij punt 1 in de onderstaande afbeelding van de edelheidreeks. Door het metaal nog hoger te legeren, gaat de potentiaal nog verder omhoog en dat zijn de punten 2 en 3. M.a.w. dan neemt de corrosiebestendigheid ook verder toe. In deze reeks is magnesium (Mg) het meest onedele metaal.
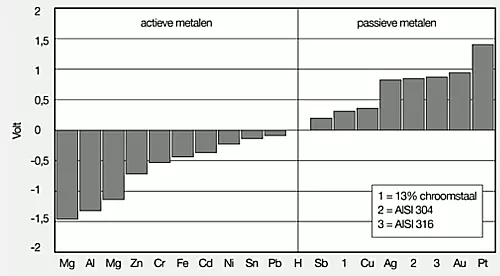
Als tijdens de bereiding van staal elementen worden toegevoegd om de eigenschappen van het staal te verbeteren dan noemt men deze legeringselementen. Voorbeelden hiervan zijn vooral chroom, nikkel, mangaan en silicium. Wordt er minstens 12% chroom toegevoegd, dan ontstaat chroomstaal. Het chroomstaal wordt dan tot op zekere hoogte roestvast. Het mechanisme hiervan berust op het feit dat bij minstens 12% chroom een goed sluitende passieve chroomoxidehuid ontstaat die het materiaal afsluit voor voortschrijdend corroderen. Dankzij het chroom kan het staal zichzelf passiveren en zal bij niet al te zware chemische belastingen goed blijven functioneren.
Het ‘geheim’ van verzinkt staal
Het metaal zink is een behoorlijk onedel metaal en de vraag kan daarom gesteld worden waarom verzinkt staal zo perfect blijft presteren in buitentoepassingen. Zink is inderdaad onedeler dan staal en dat is goed te zien in de edelheidsreeks. Dit houdt tevens ook in dat verzinkte lagen een prima kathodische bescherming geven. Dankzij de aanwezigheid van water en lucht vormt zink aan het oppervlak een laagje zinkpatina. Zinkpatina is feitelijk gekristalliseerd basisch zinkcarbonaat en dat is niet oplosbaar in water. Hier wordt dan gelijk het geheim verklaard dat deze patinalaag in tact blijft want bijvoorbeeld regenwater spoelt niets weg. Een andere eigenschap van deze laag is dat allerlei poriën in de zinklaag worden afgedicht waardoor de verwering van de zinklaag aanzienlijk wordt vertraagd. Wordt de zinkpatinalaag beschadigd, of verwijderd door bijvoorbeeld schuren, dan is er in feite niets aan de hand want deze laag wordt weer snel opnieuw gevormd door de lucht zodat deze bescherming weer terugkomt.
Dit laagje kan echter wel in een zuur milieu worden opgelost maar zodra deze zure belasting weg is, zal ook dan het zinkpatina weer opnieuw worden gevormd. De conditie en de wijze waarop deze patinalaag wordt gevormd is uiteindelijk bepalend voor de levensduur van de zinklaag. Een zinklaag die enigszins verweerd is, biedt meer resistentie tegen weersinvloeden dan een vers aangebrachte zinklaag. Ook kan op de zinklaag desgewenst een poedercoating worden aangebracht. Men spreekt dan van een duplex systeem. Zink biedt dankzij de zinkzouten een unieke corrosieprestatie op staal in vergelijking met andere onedele elementen zoals cadmium en aluminium, die dat niet of nauwelijks hebben. Zinklagen kunnen op vier verschillende wijzen aangebracht worden, t.w. door thermisch en elektrolytisch verzinken alsmede sheradiseren en zinkspuiten. Het thermisch proces gebeurt door onderdompeling in een zinkbad en het elektrolytisch verzinken verloopt door een galvanisch proces. Bij sherardiseren komt d.m.v. diffusie een legeringslaag van zink/ijzer tot stand. Met zinkspuiten wordt zinkpoeder in gesmolten toestand op een gebeitst stalen oppervlak gespoten; dit noemt men ook wel scooperen. Alle deze processen beogen dezelfde bescherming van het staal, dat is de vorming van de patinalaag.
Vind hier ook mijn blogs welke geschreven zijn voor AluRVS Staal: https://www.alurvs.nl/staal/blog/
