HOE ONTSTAAN METAALKRISTALLEN?
Metalen zijn opgebouwd uit kristallen die ook wel korrels worden genoemd. Deze kristallen zijn op hun beurt weer opgebouwd uit atomen die zich in een bepaalde richting hebben geconfigureerd. Het atoom is de kleinste elementaire drager van de eigenschappen van een metaal. Dat neemt niet weg dat het atoom zelf ook weer uit twee hoofdbestanddelen bestaat namelijk de kern en het stelsel van elektronen. De kern bevat protonen en neutronen en de kern heeft dankzij de protonen een positieve elektrostatische lading.
De elektronen daarentegen bezitten een negatieve eenheidslading en dat trekt elkaar immers aan. De elektronen draaien rond de kern en dat is het resultaat van de centrifugale werking van het snel bewegende elektron en de aantrekkingskracht van de kern. De buitenste elektronen hebben een minder sterke binding met de kern en kunnen gemakkelijk overspringen in een aangrenzend atoom. Dat is ook de reden dat een metaal elektrische stroom kan geleiden. Het zijn ook deze elektronen die een bindingssluier c.q. wolk vormen en op deze wijze de atomen bij elkaar houden waardoor een metaalbinding ontstaat. Ieder atoom trilt om zijn eigen centrum en de amplitude is rechtstreeks afhankelijk van de temperatuur. Zie ook dit blog . Er is nog veel meer mee te delen over de opbouw van een atoom maar daar is deze blog niet voor bedoeld.
Bij een bepaalde verhitting wordt een metaal vloeibaar. Dan is de amplitude van de atomen dusdanig groot geworden dat de samenhang hiervan verandert waardoor het vloeibaar wordt. Gaat de temperatuur nog verder omhoog dan zal het metaal op den duur zelfs gaan verdampen. Dit kan dan weer gebruikt worden om bepaalde voorwerpen op te dampen met een uiterst dun metaallaagje.
Zodra een vloeibaar metaal gaat stollen dan wordt de amplitude van de atomen steeds geringer en zal er op een bepaald moment de stolling starten. Dat vraagt om een bepaalde drempelenergie waarbij we de natuur a.h.w. een handje moeten helpen. Het stollen wordt namelijk vergemakkelijkt op een kiem waar de primair stollende atomen zich gemakkelijk kunnen afzetten. Dit is het prille begin van de kristalvorming. Zo’n kiem kan een uiterst kleine verontreiniging zijn maar ook worden in de praktijk bewust kiemstoffen in de smelt toegevoegd waardoor de stolling op veel meer plaatsen tegelijk kan beginnen. Als de temperatuur verder gaat zakken, gaan deze kristallen verder groeien totdat zij tegen elkaar aankomen. Op deze wijze worden er kristalgrenzen gevormd. Hoe meer kiemplaatsen er zijn hoe fijner de structuur wordt.
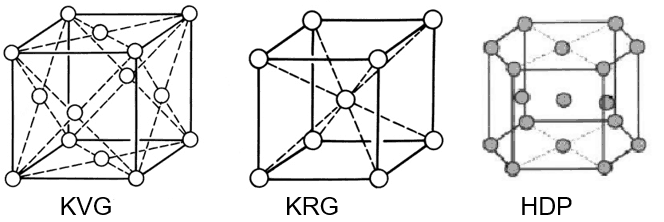
Een kristal bevat dus atomen die op verschillende manieren gerangschikt kunnen zijn. Bekende voorbeelden zijn kubisch vlakken (KRG) en kubisch ruimtelijk gecentreerd (KVG) rooster en een hexagonale opbouw (HDP). Zie bovenstaande afbeelding.
Koolstofstaal heeft een KRG rooster terwijl austenitisch roestvast staal een KVG rooster heeft. Dit heeft een grote invloed op de fysische en mechanische eigenschappen van het metaal. Zo is een KRG rooster te magnetiseren en een KVG rooster niet. Titanium en zirkonium hebben een HDP rooster. Tussen de atoomlagen ontstaan glijvakken die wat zeggen over de vervormbaarheid van het metaal. HDP heeft slechts twee glijvakken en austeniet heeft er 8 en dat betekent dat austeniet veel gemakkelijker te deformeren is dan het veel stuggere titanium.
Zoals op de bovenstaande afbeelding is te zien, kan een KVG en een KRG rooster voorgesteld worden als denkbeeldige kubus met o.a. op de hoekpunten een atoom. Indien deze kubusjes naar alle kanten gestapeld worden dan ontstaat er een stukje metaal. Ieder kristal is dan opgebouwd uit dergelijke kubusjes die evenwijdig aan elkaar verbonden zijn. Omdat de richting van de kubusjes willekeurig is per kristal zal op de korrelgrenzen dislocaties ontstaan en dat zijn per definitie roosterfouten. Dergelijke dislocaties zorgen ervoor dat de kristalgrenzen minder edel zijn dan de kristallen zelf en dat kan leiden tot preferente aantasting van deze grenzen in een chemisch milieu.
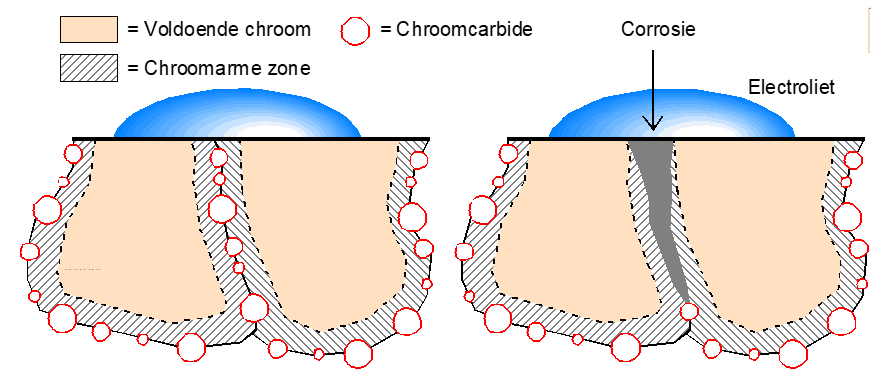
Doordat er op kristalgrenzen wat meer ruimtes ontstaan vanwege deze dislocaties kunnen op die plaatsen zich ook gemakkelijk chroomcarbiden vormen zodra het materiaal in het sensitieve gebied komt. Deze chroomcarbiden onttrekken veel chroom in de buurt van deze carbiden waardoor er plaatselijk te weinig chroom overblijft om het materiaal plaatselijk passief te houden. Dat betekent in een corrosief milieu dat er interkristallijne corrosie zal ontstaan. Dat kan voorkomen worden door het materiaal oplossend te gloeien waardoor deze chroomcarbiden weer verdwijnen.